近日,基础医学院陈腾祥团队和附属医院潘卫/赵淑云团队合作在生殖生理及生殖医学研究领域取得重要进展,研究成果论文“HDAC6-dependent deacetylation of NGF dictates its ubiquitination and maintains primordial follicle dormancy”发表于Theranostics(IF:12.4)。该研究报道组蛋白去乙酰化酶HDAC6调控原始卵泡休眠进而维持卵巢生殖力的分子机制。

原始卵泡于出生前后形成,随即绝大多数原始卵泡进入休眠状态。少量的休眠原始卵泡被从卵泡库中选择出来激活发育为初级卵泡的过程称作原始卵泡选择性激活。由于原始卵泡数目有限且不可更新,而休眠原始卵泡一旦进入生长状态便无法逆转。原始卵泡选择性激活的有序发生直接影响卵泡消耗速度,从而决定雌性生殖寿命的长度[1-3]。探究原始卵泡选择性激活的分子机制将为女性生殖力保护提供重要理论依据。
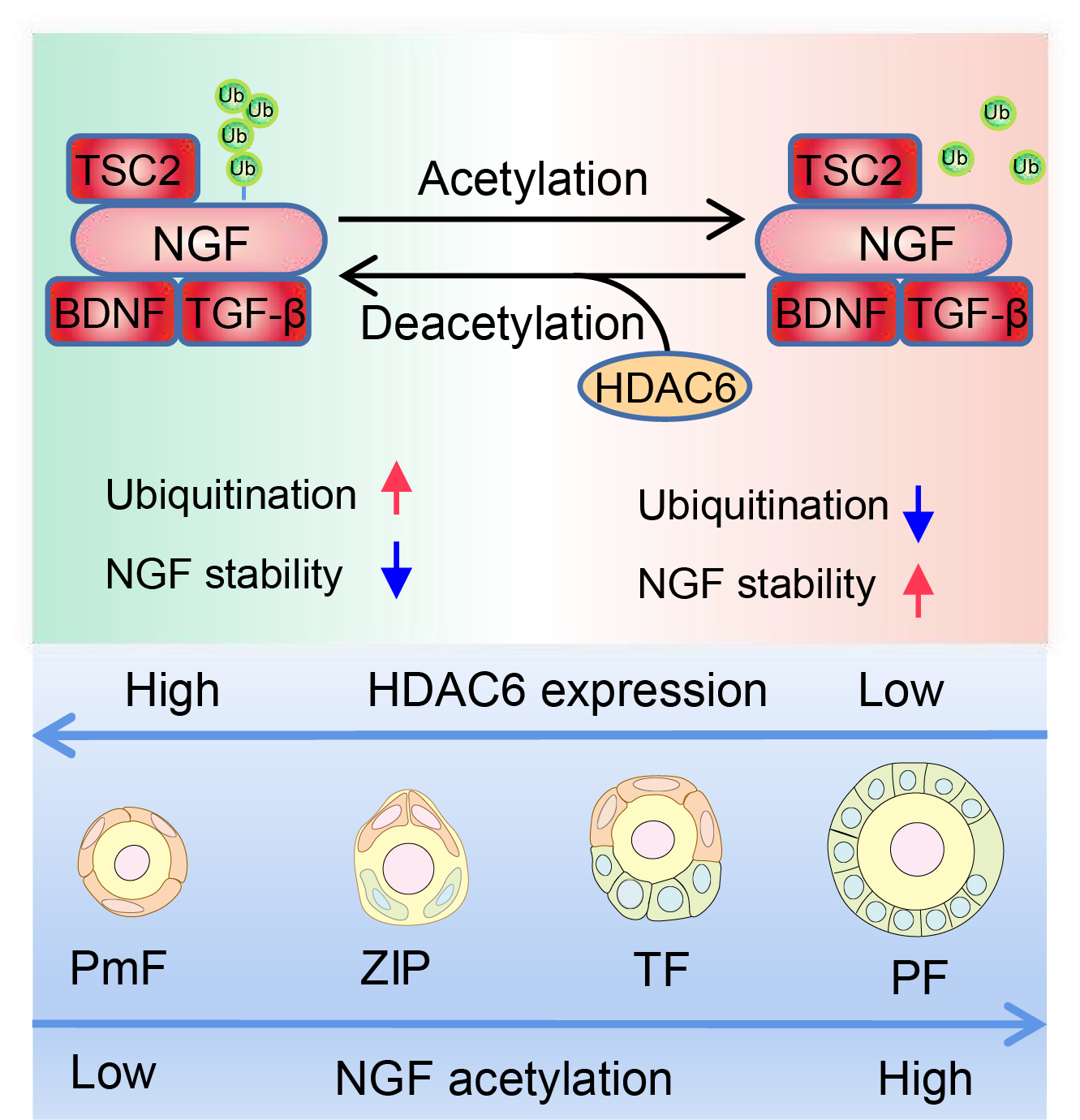
研究显示HDAC6在约3%-4%的原始卵泡中表达较低,低表达HDAC6的原始卵泡将被激活[4]。在多种卵巢衰老小鼠模型和卵巢储备减退病人的颗粒细胞中HDAC6的表达降低。HDAC6在绝大多数原始卵泡中高表达。利用卵巢体外培养模型研究发现抑制Hdac6促进小鼠和人原始卵泡激活。过表达Hdac6转基因小鼠模型研究显示,过表达HDAC6延缓原始卵泡激活速度从而延长小鼠生殖寿命。多组学和实验验证发现下调HDAC6之后,调控原始卵泡选择性激活的关键蛋白NGF显著增加,促进原始卵泡选择性激活。HDAC6具有去乙酰化催化结构域和泛素化结构域。HDAC6通过降低NGF的乙酰化修饰水平,NGF乙酰化水平降低之后加速NGF泛素化降解,最终NGF蛋白水平降低,维持原始卵泡休眠。绝大多数原始卵泡中高表达HDAC6的生理意义在于降低NGF的表达,防止原始卵泡激活以维持雌性生殖力。当HDAC6在少数原始卵泡中表达降低之后,NGF表达增加,原始卵泡激活进一步生长发育,维持周期性卵泡募集和排卵,贡献于生殖繁衍。
贵州医科大学基础医学院陈腾祥教授/徐国强教授和贵州医科大学附属医院潘卫教授和赵淑云教授为文章的共同通讯作者,基础医学院张拓博士和童云通硕士研究生为文章的并列第一作者。基础医学院和附属医院多名师生参与该研究。我校贵州常见慢性疾病发病机制及药物研究重点实验室和基础医学科学研究中心提供了仪器和技术支持。
该项目受多项国家自然科学基金资助,是学校近年来围绕“双一流”内涵建设,持续完善创新团队和优秀青年科技人才政策体系的成果之一,对推动我校基础与临床融合平台建设具有重要意义。
张拓博士为我校近年引进博士青年人才,入选贵州医科大学优秀青年人才培养计划和贵州省第七批千层次人才,2024年以(共同)第一作者在Science Bulletin(IF:18.9)、Theranostics(2篇;IF:12.4)等杂志发表多篇关于卵泡发生发育调控机制的研究论文。
参考文献:
[1] Zhang H, Liu K. Cellular and molecular regulation of the activation of mammalian primordial follicles: somatic cells initiate follicle activation in adulthood. Hum Reprod Update. 2015; 21: 779-86.
[2] Zhang T, He M, Zhang J, Tong Y, Chen T, Wang C, et al.Mechanisms of primordial follicle activation and new pregnancy opportunity for premature ovarian failure patients. Front Physiol. 2023; 14: 1113684
[3] Zhang H, Panula S, Petropoulos S, Edsgärd D, Busayavalasa K, Liu L, et al. Adult human and mouse ovaries lack DDX4-expressing functional oogonial stem cells. Nat Med. 2015; 21: 1116-8.
[4] Zhang T, He M, Zhao L, Qin S, Zhu Z, Du X, et al. HDAC6 regulates primordial follicle activation through mTOR signaling pathway. Cell Death Dis. 2021; 12: 559.
 学院首页
学院首页
 当前位置:
学院首页
>
正文
当前位置:
学院首页
>
正文
 学院首页
学院首页
 当前位置:
学院首页
>
正文
当前位置:
学院首页
>
正文